Набагато більше, ніж просто збереження крові
Кров дефіцитна та дорога. Крім того, сучасні дослідження показали, що переливання крові є фактором ризику збільшення смертності в лікарнях та численних ускладнень для здоров'я.
З цих причин і на підставі відомих керівних принципів та фактичних даних в медичному центрі Франкфуртського університету було запроваджено концепцію збереження крові пацієнтів. Три основні заходи спрямовані на те, як оптимально використовувати переливання донорської крові:
1. Спеціальне попереднє лікування пацієнтів високого ризику перед хірургічними
процедурами
2. Мінімізація втрати крові під час та після операції
3. Стандартизований тест, щоб визначити, чи справді переливання крові є
обґрунтованим
Звичайна практика переливання концентрату еритроцитарних клітин (ЕЦК) у різних країнах світу сильно відрізняється. Маючи понад 50 трансфузійних концентратів ЕЦК на 1000 жителів, Німеччина займає перше місце в Європі та у всьому світі (для порівняння, Австралія має їх 36, Нідерланди — 34; Норвегія — 42; Великобританія — 36; Швейцарія — 41).1,2 Однак, за умов медичних та суспільних змін заготовлена кров стане все більш дефіцитним ресурсом. Дуже перспективним підходом до вирішення цього питання є концепція мультидисциплінарного збереження крові пацієнтів (ЗКП), реалізації якої, до речі, сприяє3 Всесвітня організація охорони здоров'я (ВООЗ) та яка представлена нижче.
Діагностика та терапія передопераційної анемії
Відповідно до критеріїв ВООЗ існує анемія, коли значення гемоглобіну падає до 12 г/дл у жінок і до 13 г/дл у чоловіків. Мусаллам та ін. повідомляють, що передопераційна анемія поширена у 30% з 227 425 госпіталізованих пацієнтів всієї вікової групи.4 У лікарні передопераційна анемія є одним із найнадійніших прогнозів для введення концентрату ЕЦК під час або після операції. Крім того, передопераційна анемія також повинна бути класифікована як окремий та незалежний фактор ризику виникнення післяопераційних ускладнень та збільшення рівня післяопераційної смертності.4. Теоретично кожну анемію слід за можливості визначати до проведення непланових та планових оперативних втручань, відкладених до завершення відповідного лікування анемії.6 Британське дослідження показало, що передопераційна корекція анемії у тісній співпраці з сімейними лікарями змогла знизити частоту передопераційної анемії від 26%
до 10% в день операції та ризик необхідності переливання крові донора протягом операції більш ніж на половину, з 26% до 13% .6
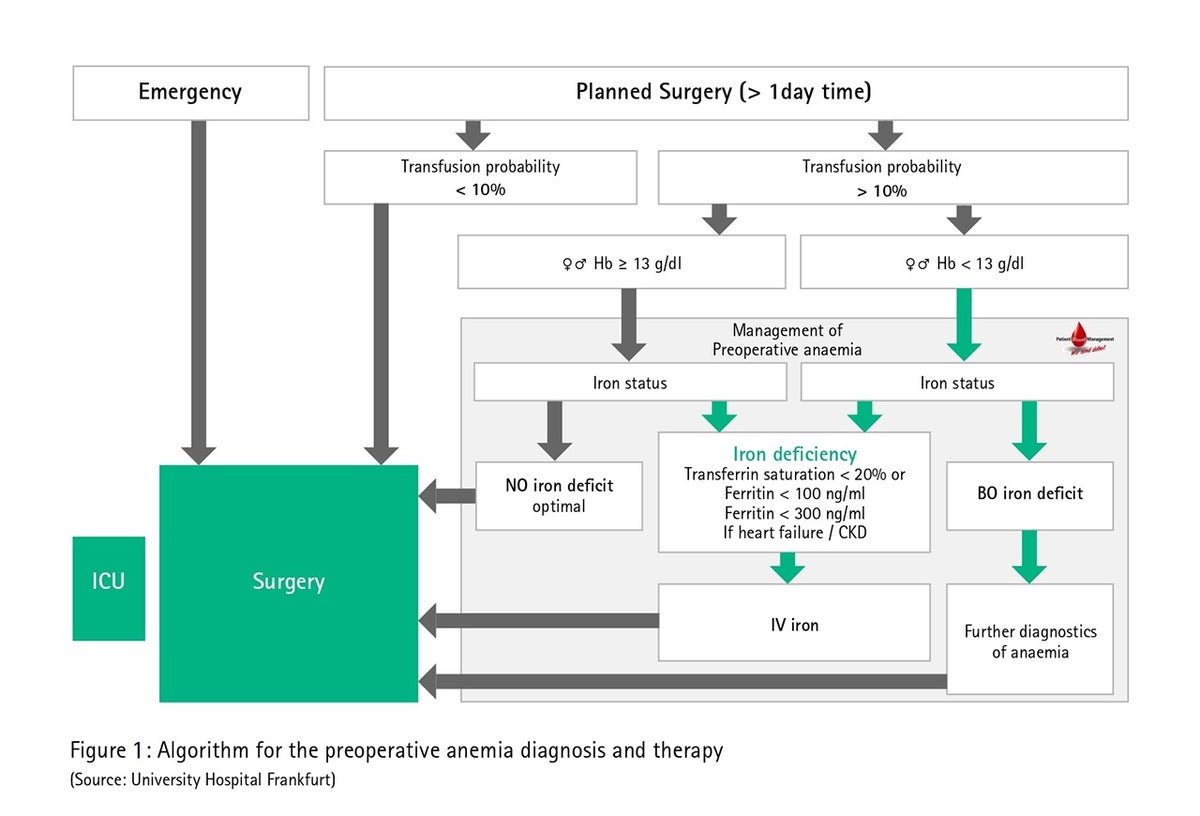
У німецьких повсякденних ситуаціях вартість внутрішньовенної терапії залізом, розмежування амбулаторної та стаціонарної допомоги, а також потенційне відкладання процедури є аргументами, які часто наводяться проти передопераційного лікування анемії. У порівнянні з переливанням крові донора, крім витрат і бюджетних аспектів, передопераційне лікування анемії також може бути корисним для самих пацієнтів (менше ризиків, пов'язаних з переливанням крові, та побічних ефектів, покращення процесів загоєння), для лікарні (залучення пацієнтів та маркетинг) та і для основної частини населення (дефіцит заготовленої крові, швидша реабілітація). На мал. 1 показаний алгоритм діагностики та терапії передопераційної анемії на прикладі медичного центру Франкфуртського університету.
Мінімізація зайвих втрат крові та захист власних резервів організму
Передопераційний збір крові та процедурні втручання можуть спричинити ятрогенну анемію.7 Відтак, тижневі втрати крові до 600 мл можуть виникати у пацієнтів інтенсивної терапії лише внаслідок проведення лабораторного дослідження крові.8 Наразі за високими розрахунками мова йде про щорічну втрату крові в 25 мільйонів літрів лише для західного світу, враховуючи чинні стандарти лабораторного збору крові, і це неминуче призводить до набутої в лікарні анемії.9 Зменшення розміру пробірок для забору крові та щоденні чіткі показання можуть значно зменшити обсяги забору та зайві втрати крові без негативного впливу на якість діагностики.10
Механізована автотрансфузія (MAT)
Технічні засоби, а саме механізована автотрансфузія, відіграють важливу роль як під час операції, так і після неї. Починаючи з розрахованої втрати крові під час операції в 0,5–1 літр, підготовка крові, втраченої протягом операції, вважається обґрунтованою, оскільки доведено, що таким чином знижується використання банків донорської крові11. Так само, слід враховувати застосування MAT у хворих на пухлини після попереднього опромінення крові, втраченої12 під час операції або шляхом використання спеціальних фільтрів, що знищують лейкоцити13.
Періопераційне лікування антикоагулянтами
Близько 1–3% населення отримує антикоагулянти постійно для профілактики артеріальної та венозної тромбоемболії або після процедури стентування. Залежно від показань тут можуть використовуватися гепарини, (прямі) пероральні антикоагулянти або інгібітори агрегації тромбоцитів. Некритичний прийом ліків за день до операції супроводжувався б дуже високим ризиком втрати крові. Проте, в цілому раннє припинення прийому ліків було б настільки ж безвідповідальним, оскільки могло б спричинити тромбоемболії або ущільнення стенту. На цьому тлі повинні бути встановлені місцеві стандарти поводження з антикоагулянтами під час операції, наприклад як частина проекту зі збереження крові пацієнта.
Визначення індивідуальних груп ризику на ранньому етапі, наприклад в амбулаторії анестезіології слід враховувати такі фактори: показання до антикоагуляції — профіль ризику тромбозу та крововиливу, супутня патологія (нирки, печінка, кістковий мозок), одночасне лікування іншими препаратами (інгібітори агрегації тромбоцитів, нестероїдні протиревматичні препарати), терміновість операції, регіональна анестезія, ризик крововиливу внаслідок запланованої операції (низький/помірний/високий) та зміна антикоагуляції (утворення мостів/перехід).14
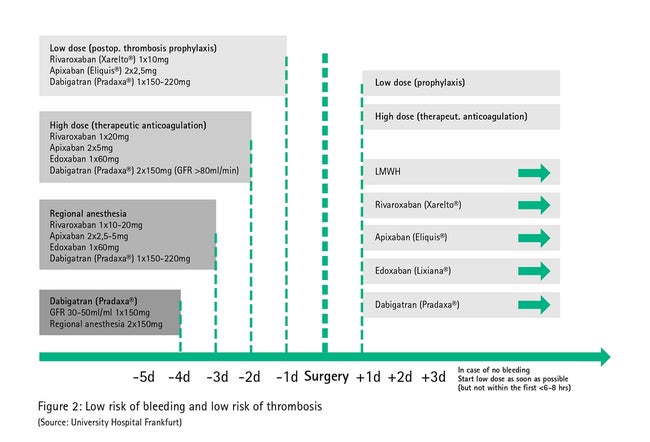
На мал. 2 описано пряме пероральне застосування антикоагулянтів у процедурах з низьким рівнем кровотечі (тих, у яких хірургічні крововиливи рідкісні, або тих, у яких хірургічні крововиливи легко контролювати завдяки їх локалізації, наприклад, у стоматологічному лікуванні, дерматології). За таких умов, внаслідок короткого періоду напіввиведення, механізована автотрансфузія в періопераційній фазі зазвичай не потрібна, оскільки необхідної перерви в терапії можна досягнути, просто пропустивши її до операції.
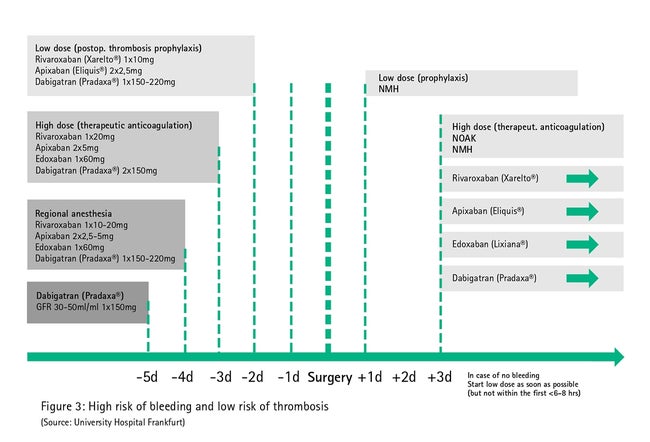
Оскільки різні супутні захворювання (наприклад, порушення функції нирок та печінки) та одночасне застосування інших препаратів (наприклад, ко-антикоагулянти) можуть бути пов'язані з відповідною геморагічною тенденцією, незважаючи на переривання 2-разового періоду напіввиведення при лікуванні, антикоагуляційну терапію прямими пероральними антикоагулянтами необхідно припинити на ранній стадії (5-разовий період напіввиведення, мал. 3) в процедурах з високим ризиком кровотечі, у яких не можна виключити крововиливів з клінічними проявами (велика черевна операція, велика операція судин, велика ортопедична операція, велика внутрішньогрудинна хірургічна процедура, прокол судин, що не притиснюються).
Інтраопераційне управління коагуляцією
Відповідний і ретельний хірургічний контроль кровотечі є основою для профілактики та ефективної терапії періопераційних крововиливів. Крім того, основні фізіологічні умови, а саме рН> 7,1, іонізований кальцій> 1,2 ммоль/л та температура > 36 °С є основними передумовами для оптимального згортання крові (гемостаз). 15 Якщо є найменша підозра на гіперфібриноліз, слід розпочати, наприклад, антигіперфібринолітичну медикаментозну терапію транексамовою кислотою.16 Однак клітинний (первинний) гемостаз може бути покращений, наприклад, аналогами вазопресину (десмопресином).17 Будь-яка інша подальша терапія повинна ґрунтуватися на цій базовій терапії, завдяки якій терапія пацієнтів з кровотечею, що заснована на алгоритмі, зокрема, забезпечує ефективний та економний контроль. Основною метою коагулопатії має бути причинно-наслідкова терапія проблеми, а не симптоматична терапія заміщенням донорської крові.
Мінливість практики переливання та пов'язана з нею імуномодуляція
Практика переливання крові, особливо щодо введення концентрату ЕЦК, сильно відрізняється в різних країнах та лікарнях, що дозволяє зробити висновок про наявність невизначеності щодо відповідного показання та про переливання можливо непотрібних алогенних препаратів крові. 2,18 Ця велика мінливість у звичайній практиці переливання крові все більше дивує, оскільки чіткі рекомендації щодо поводження з препаратами крові були визначені в Німеччині у міжсекційних керівних положеннях Німецької медичної асоціації12. Відтак за ними рекомендовано враховувати критерії концентрації гемоглобіну у пацієнтів, компенсаційну здатність та критерії фактору ризику.
Що стосується потенційних ризиків концентрату ЕЦК, відомими є пов’язані з трансфузією передавання бактерій, вірусів, паразитів або прионів, а також імунообумовлені побічні реакції на препарати (наприклад, об'ємне перевантаження, пов'язане з трансфузією, гіпотермія, гіперкаліємія, перевантаження цитратом, трансфузійний гемосидероз).19
Крім того, переливання препаратів клітинної крові, як-от «трансплантація рідкої крові органів», а не сумісність групи крові є насправді імунологічним викликом для організму реципієнта. Імунообумовлені ризики включають:
- Алергічна реакція при переливанні
- Фебрильна негемолітична реакція при переливанні
- Гостра легенева недостатність, пов’язана з переливанням
- Гемолітична реакція при переливанні
- Трансплантат, пов’язаний з переливанням, порівняно із захворюванням організму господаря
- Імуномодуляція, пов’язана з переливанням
Довгострокове значення, яке існує для імуномодуляції, пов’язаної з переливанням, є предметом клінічних досліджень. Зрештою, концентрат ЕЦК, як і інші ліки з відповідним спектром побічних реакцій, слід вводити виключно раціонально та за медичними показаннями. Наприклад, за допомогою комп'ютеризованої системи вимог до алогенного концентрату ЕЦК з алгоритмом запрограмованого рішення, заснованого на керівних положеннях та документуванні відповідного тригера трансфузії в Стенфорді (США), частка введення концентрату ЕЦК, що не відповідає керівним положенням, була знижена з 66 % до менше ніж 30% між 2009 та 2012 роками від усіх переливань, а загальна кількість концентрату ЕЦК на 24% .20
Висновок
Основна увага мультимодального ЗКП спрямована на захист та зміцнення власних ресурсів пацієнта. Цього можна досягти шляхом розпізнавання та лікування анемії, досконалого зменшення періопераційної втрати крові, обмеження обсягу зборів крові з діагностичною метою, утворення концепції коагуляції та гемотерапії на основі фактичних даних, а також раціонального показання до введення концентрату ЕЦК відповідно до керівних принципів. Вплив концепції ЗКП на німецькі лікарні досліджується в багатьох центрах.21
Збереження крові пацієнта допомагає врятувати кров
Збереження крові пацієнта (ЗКП) було запроваджено в медичному центрі Франкфуртського університету в липні 2013 року з метою захисту та використання власних ресурсів крові пацієнта. Більше того, під час операції та після неї проводиться більше робіт для захисту крові, ніж будь-коли раніше: Протягом організаційного процесу перевіряється, чи згортання крові пацієнта працює добре, а кров, втрачена під час операції, готується до повернення. За свою прихильність концепції лікарня отримала премію з безпеки пацієнтів за 2016 рік, яку щороку присуджує Активна група з безпеки пацієнтів. Академія Ескулап в місті Татлінген є однією зі спонсорів премії. Збереження крові пацієнта дозволяє лікарям зменшити потребу в переливанні крові на десять відсотків, тим самим знижуючи ризик гострого ураження нирок у пацієнта, що оперується, а також пов'язані з цим витрати. Дослідження, проведене у 130 000 пацієнтів, довело користь для пацієнтів. Вже більше 100 лікарень по всій Німеччині працюють над впровадженням концепції ЗКП.
Проф. Д-р мед. Патрік Мейбом та Проф. Д-р мед. Кай Захаровський
Контакти

Список літератури
1. Hofmann A, Ozawa S, Farrugia A, Farmer SL, Shander A: Economic considerations on transfusion medicine and patient blood management. Best Pract Res Clin Anaesthesiol 2013; 27: 59-68.
2. Van Der Poel CL, Janssen MP, Behr-Gross ME: The collection, testing and use of blood and blood components in Europe: 2008 Report. https://www.edqm.eu/en/blood-transfusion-reports-70.html (last accessed on 20/12/2014.
3. World Health Organization (WHO): The World Health Assembly. Resolution on availability, safety and quality of blood safety and quality of blood products (WHA 63.12) http://www.who.int/bloodsafety/transfusion_services/self_sufficiency/en/ (last accessed on 20/12/2014.
4. Musallam KM, Tamim HM, Richards T, et al.: Preoperative anaemia and postoperative outcomes in non-cardiac surgery: a retrospective cohort study. Lancet 2011; 378: 1396-407.
5. Goodnough LT, Maniatis A, Earnshaw P, et al.: Detection, evaluation, and management of preoperative anaemia in the elective orthopaedic surgical patient: NATA guidelines. Br J Anaesth 2011; 106: 13-22.
6. Kotze A, Carter LA, Scally AJ: Effect of a patient blood management programme on preoperative anaemia, transfusion rate, and outcome after primary hip or knee arthroplasty: a quality improvement cycle. Br J Anaesth 2012; 108: 943-52.
7. Qaseem A, Alguire P, Dallas P, et al.: Appropriate use of screening and diagnostic tests to foster high-value, cost-conscious care. Ann Intern Med 2012; 156: 147-9.
8. Koch CG, Reineks EZ, Tang AS, et al.: Contemporary bloodletting in cardiac surgical care. Ann Thorac Surg 2015; 99: 779-84.
9. Levi M: Twenty-five million liters of blood into the sewer. J Thromb Haemost 2014; 12: 1592.
10. Ranasinghe T, Freeman WD: 'ICU vampirism' - time for judicious blood draws in critically ill patients. Br J Haematol 2014; 164: 302-3.
11. Wang G, Bainbridge D, Martin J, Cheng D: The efficacy of an intraoperative cell saver during cardiac surgery: a meta-analysis of randomized trials. Anesth Analg 2009; 109: 320-30.
12. Vorstand der Bundesärztekammer auf Empfehlung des Wissenschaftlichen Beirats: Querschnitts-Leitlinien (BÄK) zur Therapie mit Blutkomponenten und Plasmaderivaten. 2014; 4. überarbeitete Auflage.
13. Catling S, Williams S, Freites O, Rees M, Davies C, Hopkins L: Use of a leucocyte filter to remove tumour cells from intra-operative cell salvage blood. Anaesthesia 2008; 63: 1332-8.
14. Giebl A, Gurtler K: [New oral anticoagulants in perioperative medicine]. Anaesthesist 2014; 63: 347-62; quiz 63-4.
15. Kozek-Langenecker SA, Afshari A, Albaladejo P, et al.: Management of severe perioperative bleeding: guidelines from the European Society of Anaesthesiology. Eur J Anaesthesiol 2013; 30: 270-382.
16. Crash- trial collaborators, Shakur H, Roberts I, et al.: Effects of tranexamic acid on death, vascular occlusive events, and blood transfusion in trauma patients with significant haemorrhage (CRASH-2): a randomised, placebo-controlled trial. Lancet 2010; 376: 23-32.
17. Weber CF, Dietrich W, Spannagl M, Hofstetter C, Jambor C: A point-of-care assessment of the effects of desmopressin on impaired platelet function using multiple electrode whole-blood aggregometry in patients after cardiac surgery. Anesth Analg 2010; 110: 702-7.
18. Gombotz H, Rehak PH, Shander A, Hofmann A: Blood use in elective surgery: the Austrian benchmark study. Transfusion 2007; 47: 1468-80.
19. Goodnough LT, Murphy MF: Do liberal blood transfusions cause more harm than good? BMJ 2014; 349: g6897.
20. Goodnough LT, Shieh L, Hadhazy E, Cheng N, Khari P, Maggio P: Improved blood utilization using real-time clinical decision support. Transfusion 2014; 54: 1358-65.
21. Meybohm P, Fischer D, Geisen C, et al.: Safety and effectiveness of a Patient Blood Management (PBM) Program in Surgical Patients - The study design for a multi-centre prospective epidemiological non-inferiority trial. BMC Health Services Research 2014; 14: 576.